|
 |
|
||||
 РАЗВЛЕЧЕНИЯ С ЖИВОТНЫМИ РАЗВЛЕЧЕНИЯ С ЖИВОТНЫМИ |
 ЭКСПЕРИМЕНТЫ ЭКСПЕРИМЕНТЫ |
 ВЕГЕТАРИАНСТВО ВЕГЕТАРИАНСТВО |
 МЕХ МЕХ |
 КОШКИ И СОБАКИ КОШКИ И СОБАКИ |
 ГУМАННОЕ ОБРАЗОВАНИЕ ГУМАННОЕ ОБРАЗОВАНИЕ |
 Видео
Видео  Фото
Фото  Книги
Книги
 Листовки Листовки
 Законы Законы
 НОВОСТИ НОВОСТИ
 О
нас О
нас
 Как
нам помочь? Как
нам помочь?
 Вестник Вестник
 СМИ СМИ
 Ссылки Ссылки
 ФОРУМ ФОРУМ
 Контакты Контакты  |

|
 ПОИСК НА САЙТЕ: ПОИСК НА САЙТЕ:
|
БИОЭТИКА - почтой |
| |
 № нашего кошелька: 41001212449697 |





|
Листовки 
Формат A5, pdf. 5 Mb 
Формат Doc. 70 Kb 
Формат Doc. 580 Kb 
Формат Doc. 150 Kb |
|
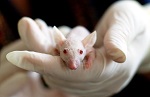
ЛАЛ-тест - надежная замена контроля пирогенности на животных Чайка Л.А., Гомон О.Н., Меркулова Ю.В., Разработка альтернативных испытаниям на животных методов - этическая проблема, которая непосредственно связана с разработкой и валидацией фармакопейных биологических тестов, используемых при контроле качества лекарственных средств. Согласно Государственной Фармакопеи СССР, XI изд., действующей пока в России и до недавнего времени - в Украине, парентеральные препараты и субстанции для их производства контролируются в испытаниях на животных по 8-ми общим статьям с несколькими разновидностями методик [1]. Для фармакологов ГНЦЛС, принимавших участие в работе над общими монографиями ГФУ по биологическим методам, а также разработавших более 400 методик биологических испытаний для частных статей, было очевидно, что замена тестов, проводимых на животных, альтернативными требует разумного анализа и четкой аргументации, подкрепленной данными статистики, т.к. затрагивает интересы, в первую очередь, пациентов, получающих парентеральные препараты, а также предприятий, производящих эти препараты, и контролирующих организаций, на которых лежит ответственность перед населением за безопасность выпускаемых препаратов. Европейская Фармакопея, с которой гармонизирована Государственная Фармакопея Украины, в связи с общемировой практикой ограничения экспериментов на животных уже более 10 лет осуществляет комплексную программу, разработанную на основе принципов "три R": усовершенствование, сокращение и замена [2]. Эта концепция была предложена в 1959 году Russel W.M.S. иВш-chR.L. [З]. Усовершенствование любой методологии направлено на снижение или
устранение болевых ощущений у животного. В Европейской Фармакопее 2002 года издания, исследования биологической активности гормонов, таких как гормон роста, окситоцин и др., заменены на методику их количественного определения хроматографически. Большое число частных монографий на вакцины уже не предусматривают биологические испытания на животных (исключение составляет контроль качества вакцин в тесте на пирогены на кроликах) [4]. Определение биологической активности инсулина, которое ранее проводилось
одним из 3 фармакопейных методов с использованием от 40 до 96 мышей
или не менее 18 кроликов, в настоящее время для целого ряда инсулинов
заменено их количественным определением с помощью жидкостной хроматографии.
Замена испытаний на животных альтернативным методом стала возможной
благодаря появлению новой субстанции инсулина, получаемой не из
поджелудочной железы животных (инсулин свиной, инсулин бычий), а
как продукт биотехнологического производства. Такой инсулин содержит
минимальное количество примесей, что и позволило проводить его количественную
оценку химическим методом. Наиболее блестящим, примером замены испытаний на животных альтернативным методом является, конечно же, замена испытания на пирогены на кроликах определением содержания бактериальных эндотоксинов с помощью ЛАЛ-теста. Появление в 1940 году фармакопейного метода - определение пирогенов в лекарственном средстве была обусловлена тем, что парентеральное введение пациенту препарата, загрязненного пирогенами, может привести к летальному исходу. Пирогенность лекарственных средств имеет в подавляющем большинстве случаев микробное происхождение и вызывается граммотрица-тельными бактериями. Это высокотоксичные для человека липополисахаридные осколки клеточных стенок, которые образуются при разрушении бактериальной клетки. Эндотоксины очень устойчивы к обычным способам стерилизации и обладают широким спектром нежелательных для человека биологических эффектов, в том числе, лихорадка, тромбоцитопения, эндо-токсический шок, резкие метаболические нарушения, анафилактический шок. Опасность пирогенных загрязнений всегда существовала в реальных
условиях фармацевтического производства. Не снизилась она и сейчас. ЛАЛ-тест, как альтернатива тесту на кроликах, впервые появился в Фармакопее США, 20-е изд., в 1980 году и получил название "Определение бактериальных эндотоксинов". В 1984 году 5 описанных в USP препаратов воды содержали ЛАЛ-тест. В 23-м издании USP 680 препаратов содержат ссылку на раздел "Бактериальные эндотоксины". Даже в Китайской Фармакопее 2000 года издания для более чем 80 инъекционных препаратов мы находим указание на контроль предельного уровня эндотоксинов. Появлению ЛАЛ-теста как фармакопейного метода предшествовала более
чем дватцатилет-няя исследовательская работа. Краб мечехвост - древнейшее морское животное, обитающее у восточных берегов Северной и Центральной Америки, Японии, Китая, Вьетнама и Индии. Мечехвостов еще называют "живущие ископаемые", т.к. современные крабы-мечехвосты мало чем отличаются от животных, чьи отпечатки обнаружены в отложенияхЮрского и Триасского периодов. Живут они на 20-метровой глубине.Bang F.B. обнаружил, что введение бактерий во внутрисосудистое русло мечехвостов вызывает свертывание крови и гибель животного [5]. Более того, как показали опыты Frederick Bang и доктора Jack Levin, сотрудника этой же лаборатории, аналогичная реакция наблюдалась при инъецировании мечехвосту не живых бактерий, а только обрывков клеточной стенке этих бактерий [6]. Каков же механизм этой реакции? У мечехвостов как очень древних и примитивных животных жидкость, переносящая кислород по организму, только отдаленно напоминает кровь человека и носит название "гемолимфа". Гемолимфа имеет голубую окраску и содержит только один тип клеток - амебоциты. Так как в морской воде, особенно в придонном ее слое - месте обитания мечехвостов, очень высока концентрация бактерий, природа подарила этим крабам примитивный, но очень надежный механизм защиты от вторжения патогенных бактерий. Любое повреждение покровов крабов-мечехвостов приводит к контакту клеток крови амебоцитов с бактериями, которые выступают в роли активаторов, "пускового механизма" реакции свертывания крови. Образовавшийся сгусток крови препятствует дальнейшей ее потере, закупоривая место повреждения, и предохраняет животное от заражения. Но несмотря на свою примитивность по сравнению с системами коагуляции млекопитающих и человека, этот защитный механизм исправно служит мечехвосту уже много миллионов лет. Levin J. сразу же понял ценность открытой ими реакции амебоцитов с эндотоксинами и возможность ее практического применения: система свертывания была уникальной - высокочувствительной и одновременно совершенно простой - все компоненты системы свертывания локализованы только в одном типе клеток - амебоцитах. Это вселяло надежду, что создание реактивов для проведения теста будет элементарнейшей операцией. Работа над созданием первого коммерческого реактива, содержащего клетки крови краба-мечехвоста, были начаты в 1970 году доктором Стенли Ватсоном, и очень маленькой на то время компанией - Associates of Cape Cod, которая первой получила лицензию FDA на производство этого реактива. Реактив получил название LAL-реактив. Аббревиатура "LAL" - сокращение,
образованное первыми буквами словосочетания "Limulus Amebocite Lisate":
Limulus - название краба по-латыни, Amebocite Lisate - лизат клеток
крови краба. Название реактива дало название тесту - LAL-тест. Таким образом, исследования Levin J. и Bang F.B. можно считать началом разработки метода количественного определения бактериальных эндотоксинов в самых различных средах. Особый интерес к этому открытию был обусловлен тем, что эндотоксины, как было уже сказано ранее, именно те вещества, которые в подавляющем большинстве случаев являются причиной пирогенности лекарственных препаратов. Наиболее важной и приоритетной областью применения этого метода стала фармацевтическая промышленность. Замена теста на пирогены альтернативным ему - определением в препарате
эндотоксинов Еще одним явным преимуществом ЛАЛ-теста перед тестом на пирогены
на кроликах является тот факт, что определенные группы инъекционных
препаратов и технологического оборудования невозможно или некорректно
испытывать на животных. К ним относятся:
Экономически выгодно заменить также тест на кроликах определением эндотоксинов для таких препаратов, введение которых животному резко ограничивает возможность его дальнейшего использования (препараты антигенной природы, препараты крови). Например, причиной гибели кроликов при введении им большинства антибиотиков является действие большой дозы антибиотика на ферменты микрофлоры и, как следствие этого, дисбактериоз или, как при введении линкомицина гидрохлорида, кандидо-микоз. Каковы источники попадания эндотоксинов в готовое лекарственное средство? Согласно регуляторным документам, опубликованным в FDA их несколько:
GMP предусматривает на производстве контроль уровня эндотоксинов
во всех перечисленных выше потенциальных источниках пироген-ной
загрязненности. В Государственной Фармакопее Украины в общей статье "Бактериальные эндотоксины" приведено 5 возможных методов проведения ЛАЛ-теста [7]: 1. Метод гелеобразования: предельное испытание Отметим, что в настоящее время существует, по меньшей мере, тридцать
два метода определения бактериальных эндотоксинов с помощью ЛАЛ-теста,
используемых для научных исследования.
Повсеместному распространению ЛАЛ-теста за рубежом способствовала,
конечно же, мировая тенденция к ограничению использования животных
в эксперименте, а также ряд факторов финансово-экономического и
маркетингового характера. Среди них важное значение имеет более
высокая надежность и универсальность этого метода, что в условиях
производства по правилам GMP является одним из рычагов повышения
конкурентноспособности продукции. За последние годы растет число фармацевтических предприятий Украины,
сделавших шаг к переходу от испытаний на кроликах к ЛАЛ-тесту. К
таким предприятиям относится ОАО "Фармацевтическая компания "Здоровье",
ХГФП "Здоровье народу", "Индар", ЗАО НПЦ "Борща-говский химико-фармацевтический
завод", ФФ "Дарница", АО "Галичфарм". Хотелось несколько слов сказать о перспективах развития теста на пирогены. Одна из причин разработки новых методов определения пи-рогенности продиктована тем, что использование крабов мечехвостов для производства ЛАЛ-реактива влияет на популяцию этих реликтовых животных. Одна из крупнейших фирм по производству ЛАЛ-реактива "Associates of Cape Cod Incorporated", признала, что смертность животных после взятия у них крови увеличивается на 3%, а исследования сотрудников FDA и ученых американских университетов говорят о повышении гибели мечехвостов на 10%. В настоящее время в Европейском Центре валидации альтернативных методов был зарегистрирован новый иммунохимическии метод контроля пирогенных загрязнений in vitro, разработанный немецким ученым Томасом Хартунгом. Метод, предложенный в 3-х модификациях, проводится с использованием цельной человеческой крови или клеток, выделенных из крови человека. Автор считает, что, предложенный им метод имеет целый ряд преимуществ по сравнению с тестом на кроликах и ЛАЛ-тестом: обладая чувствительностью последнего, позволяет контролировать пироген-ные загрязнения "неэндотоксиновой" природы. В настоящее время, с полным на то основанием можно утверждать, что ЛАЛ-тест, пришедший на смену испытаниям на кроликах, не только позволяет во много раз увеличить надежность и воспроизводимость этого метода, но и является примером совершенно обоснованного ограничения использования животных в эксперименте при биологическом контроле безопасно-лекарственных средств. Литература
|



 ВАЖНО!
ВАЖНО!